Feb 21 2022
/
Il collagene, una macromolecola naturale per la realizzazione di prodotti circolari
Il collagene, una macromolecola naturale per la realizzazione di prodotti circolari
Intervento di Salvatore Iannace, Direttore Istituto di Scienze e Tecnologie Chimiche “Giulio Natta” (SCITEC-CNR)
Pubblicato sulla rivista CPMC n.3 (2021)
La natura è in grado di produrre una grande varietà di materiali e strutture combinando pochi componenti tra cui macromolecole e minerali. Tra le macromolecole ci sono sia le proteine, come ad esempio il collagene e la seta, oppure i polisaccaridi, come la cellulosa e la chitina. Queste vengono assemblate in compositi multiscala insieme ai minerali (tipicamente sali di calcio o silice) per dare origine a strutture complesse e multilivello come ad esempio l’osso oppure il legno.
La complessità dei materiali naturali ha affascinato e continua ad affascinare scienziati ed ingegneri che si ispirano a queste strutture per sviluppare materiali con proprietà avanzate da un punto di vista strutturale o funzionale. I materiali naturali sono anche una fonte rinnovabile per lo sviluppo di nuovi prodotti circolari come le bioplastiche. A tal riguardo esistono numerosi esempi di materiali basati sia su polisaccaridi come l’amido, la cellulosa, gli alginati o il chitosano ma anche su proteine sia di origine animale come il collagene, la gelatina, la cheratina o le proteine del siero, che di origine vegetale come il glutine e la zeina.
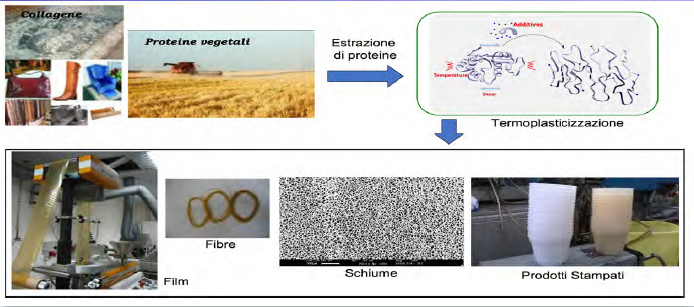
Per essere trasformati con tecnologie di manifattura compatibili con il mondo delle plastiche le macromolecole naturali devono essere “denaturate” ovvero è necessario rimuove la loro organizzazione gerarchica e le interazioni specifiche. Nel caso delle proteine ciò significa modificare la struttura secondaria, terziaria e quaternaria attraverso diverse metodologie fisiche o chimiche che includono l’uso del calore, della pressione, degli sforzi meccanici oppure l’impiego di acidi o basi. La denaturazione viene quindi utilizzata deliberatamente quando si vogliono realizzare films, fibre o rivestimenti. La perdita di ordine che si ottiene in seguito ad un processo di denaturazione delle proteine rende queste macromolecole naturali molto più simili ad un polimero sintetico e ciò consente l’utilizzo di tecnologie impiegate per la trasformazione di materiali plastici. In principio esistono due approcci: processi che richiedono l’uso di solventi (wet process) oppure processi di termoplasticizzazione (dry process). Nel primo caso le proteine vengono disperse in un solvente che viene successivamente rimosso attraverso una fase di essiccazione o mediante scambio di solvente-non solvente. Questa tecnica è quella più largamente utilizzata per realizzare film sottili, fibre o spugne. Nei processi di termoplasticizzazione, la denaturazione delle proteine e la formazione di un tipico fuso polimerico avviene invece attraverso la somministrazione contemporanea di energia termica e meccanica in grado di rompere le interazioni molecolari. In questo modo è possibile utilizzare tecnologie di estrusione tipiche dei materiali plastici tradizionali quali ad esempio la filmatura, lo stampaggio a compressione, la schiumatura oppure la filatura da fuso.
A causa dei forti legami tra le macromolecole, la termoplasticizzazione richiede l’utilizzo di plasticizzanti, ovvero di molecole a basso peso molecolare, in genere polari ed idrofile che possiedono una buona compatibilità con le proteine. Spesso sono miscele di diverse sostanze tra cui acqua, monosaccaridi, oligosaccaridi, polioli, lipidi o loro derivati. Il glicerolo è tra le molecole più utilizzate per le proteine come la gelatina, il glutine, le proteine della soia o del mais. Il suo ruolo è quello di ridurre la temperatura di fusione delle proteine e la viscosità del fuso al fine di evitare processi degradativi durante la loro trasformazione. L’impiego delle proteine per la realizzazione di bioplastiche presenta però alcune limitazioni in quanto, rispetto alle plastiche sintetiche, le macromolecole naturali sono generalmente meno resistenti all’acqua e presentano una ridotta resistenza alla temperatura. Per questo motivo è spesso necessario intervenire attraverso una modifica della struttura chimica delle macromolecole oppure attraverso la miscelazione con altri polimeri in maniera da ottenere sistemi compositi ed eterogenei che contribuiscono a minimizzare gli svantaggi che presentano i singoli componenti. Le tecnologie di estrusione sono state utilizzate con successo per alcune tipologie di proteine vegetali come la zeina ed il glutine ma c’è ancora molto da studiare in merito all’uso delle proteine del collagene denaturato. E’ infatti possibile ottenere un fuso polimerico che può essere processato in estrusione in un intervallo di temperatura di 80-160°C e, inoltre, attraverso la miscelazione con altri biopolimeri e/o cariche in grado di conferire specifiche proprietà strutturali e funzionali si può sviluppare una vasta gamma di bioplastiche per diverse applicazioni. Le tecnologie di estrusione applicate alle proteine di scarto dell’industria delle pelli rappresenta quindi una grande opportunità, in un’ottica di economia circolare, per lo sviluppo di nuovi materiali biobased che possono essere reimpiegati sia nell’industria delle pelli che in altre applicazioni dove, ad esempio in agricoltura, sono richiesti requisiti funzionali come la biodegradabilità programmata.
Vuoi ricevere la copia di CPMC? Iscriviti QUI per leggere la rivista ufficiale della Stazione Pelli e non perderti i prossimi numeri.

Related Posts

Balducci: “La Stazione Sperimentale Pelli rende le imprese più forti”
Il presidente intervistato dalla rivista Arsutoria: “La Stazione Sperimentale deve essere in prima linea per rendere…

Accordo Stazione Pelli-Enea per un settore conciario più sostenibile
Identificare processi produttivi innovativi a ridotto impatto ambientale nel settore dell’industria conciaria, anche con un…

MIA Fondazione ITS: al via il corso per formare tecnici esperti in pelli e nuovi materiali
E’ incominciato il 28 dicembre 2018 a Solofra, presso l’Istituto “G. Ronca”, il corso formativo “Tecnico…

Nel Comprensorio Olivetti il nuovo Headquarter della Stazione Sperimentale
Dal 18 Febbraio è operativa la nuova sede della Stazione Sperimentale Industria Pelli presso un…
