Il punto isoelettrico nel collagene e la sua determinazione
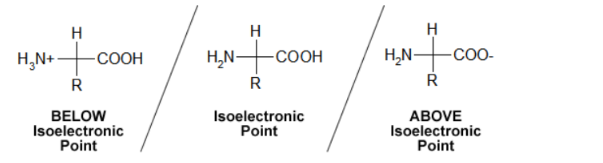
L’IEP o punto isoelettrico, di una proteina è il pH al quale la proteina non ha carica netta, o meglio le cariche positive sono della stessa entità di quelle negative. Quando il pH < IEP: catene laterali più basiche di aminoacidi si protonano per dare alla proteina una carica netta positiva.
Quando invece il pH > IEP: le catene laterali più acide si deprotonano, conferendo alla proteina una carica netta negativa.
La proteina contiene catene laterali cariche le quali, nel suo punto isoelettrico, il numero di catene laterali cariche positivamente è uguale al numero di catene laterali caricate negativamente.
Una modalità sperimentale per la misura del punto isoelettrico di proteine in soluzione è la determinazione del potenziale zeta della soluzione o il potenziale elettrocinetico .
Riprendendo i concetti dell’effetto combinato del moto delle particelle e dei fenomeni elettrici si può applicare tecniche diverse come:
- Elettroforesi: si riferisce al movimento della particella rispetto al liquido stazionario sotto l’influenza di un campo elettrico applicato
- Elettroosmosi: un liquido o una soluzione elettrolitica, si muove su una superficie carica sotto l’influenza di un campo elettrico, sostanzialmente complementare all’elettroforesi, dove si misura la pressione necessaria per controbilanciare il flusso elettro osmotico
- Potenziale di flusso: conseguenza di un campo elettrico creato quando un liquido (un elettrolita) si forma costretto a scorrere su una superficie carica
- Potenziale di sedimentazione: dovuto al campo elettrico creato dalle particelle cariche che sedimentano in un liquido.
Il potenziale Z può essere calcolato facendo ricorso a modelli teorici, misurando sperimentalmente la mobilità elettroforetica o facendo ricorso a fenomeni elettroacustici.
Nel caso dell’elettroforesi, ad un potenziale opportuno applicato si misura, attraverso metodi ottici e/o light scattering, la mobilità delle particelle cariche o mobilità elettroforetica (u), la quale è proporzionale al potenziale Z () attraverso l’equazione semplificata di Hückel = / dove e = costante dielettrica dell’elettrolita, h= la viscosità del solvente.
Sebbene la dimensione delle particelle e la sua misurazione siano intuitivamente familiari ai tecnologi delle particelle, il concetto del punto isoelettrico o di punto di carica zero (pzc) è meno ampiamente compreso e applicato. Il Pzc è correlato alla carica sulla superficie della particella e dipende fortemente dal pH della materiale; quindi, influenza un’ampia gamma di proprietà dei materiali colloidali, come la loro stabilità, interazione con elettroliti, reologia della sospensione e capacità di scambio ionico.
Nello studio proposto tratto dal lavoro di M. NASIRUDDIN KHAN (1) , la dipendenza dal pH delle cariche superficiali è stata quantificata per quattro diversi materiali disciolti in acqua: carbone attivo, sabbia di granito, carbone lakhra e mais utilizzando tre metodi: (1) la deriva del pH (misurando il pH in cui l’adsorbente si comporta come una specie neutra; (2) potenziometrico (titolazione, misurando l’adsorbimento di H+ e OH− su superfici in soluzioni a varia forza ionica; (3) valutazione diretta della carica superficiale tramite adsorbimento di ioni aspecifici in funzione del pH.
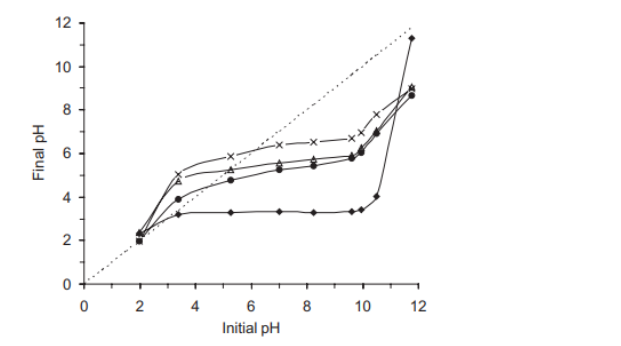
Il pzc potrebbe essere determinato anche per dispersioni di proteine o di collagene in acqua mediante titolazione potenziomentrica. Il pH finale è stato misurato e tracciato rispetto al pH iniziale. Il pH a cui la cui curva attraversa il pHinitial = la linea pHfinale è stata presa come il pzc, utilizzando un pHmetro Orion 710 con un elettrodo di vetro per le misure potenziometriche (figura1).
Una sperimentazione dimostrativa sul pzc di materiali diversi dal collagene è stata qui presentata:
In tabella 1 sono esposti i risultati di alcuni materiali sul punto isoelettrico, pzc, il punto zero dell’effetto sale, pzse, il punto zero per la carica netta protonica, pznpc e il punto zero della carica netta pznc. Nel nostro caso solamente il pzc è di nostro interesse sperimentale.
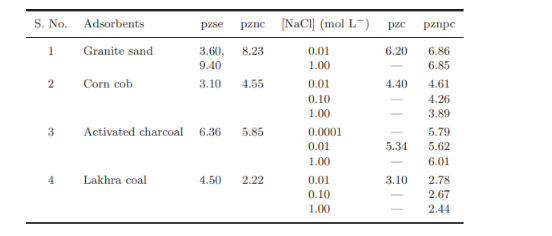
Tabella 1
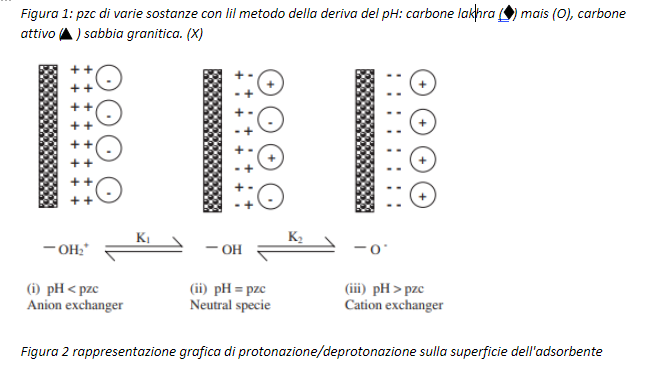
Al pzc non vi è carica superficiale da neutralizzare da parte di ioni (figura 1e 2) e tutti gli ioni adsorbiti esistenti dovranno essere legati in complessi di superficie.
Quattro adsorbenti sono stati usati per descrivere la differenza tra i punti di carica zero e sebbene gli adsorbenti studiati siano di natura eterogenea, la determinazione della carica superficiale ha dimostrato un comportamento affidabile e confermato da altri autori (2,3).
Di conseguenza, i metodi descritti in questo documento sono stati applicati anche per solidi naturali e trattati con buona ripetibilità. I pzc del gli adsorbenti studiati sono inferiori a 7, a dimostrazione dell’esistenza di un perfetto equilibrio di carica nella regione acida tra gli ioni equilibrati in soluzione acquosa.
Le informazioni raccolte da questi esperimenti possono essere utilizzate per caratterizzare il pzc di altri materiali per la comprensione delle proprietà differenti come la capacità di scambio ionico all’interfaccia di superfici cariche come nel collagene.
Bibliografia:
- Determination of points of zero charge of natural and treated adsorbents J NASIRUDDIN KHAN∗ and ANILA SARWAR† ∗Department of Chemistry, University of Karachi, Pakistan †Fuel Research Centre, PCSIR Karachi, Pakistan 2007 Surface Review and Letters 14(03):461-469
- Davranche and J. C. Bollinger, J. Colloid Interf.Sci. 227 (2000) 531.
- Wen, Q. Du and H. Tang, Environ. Sci. Technol.32 (1998) 870.
A cura di
Marco Nogarole, Responsabile del Trasferimento Tecnologico della SSIP
Pubblicato il: 30 Giu 2022 alle 14:14